欢迎光临武汉研谷生物技术有限公司!

 更新时间:2025-08-19
更新时间:2025-08-19  浏览次数:0
浏览次数:0一、实验前准备
细胞:选择处于对数生长期(一般密度为80%-95%,不要使细胞长得过密)、状态良好且无污染的细胞进行冻存。在冻存前一天,更换新鲜的完全培养基,确保细胞处于最佳生长状态。
培养基:准备适量的细胞培养所用的完全培养基,根据细胞类型确定其配方,如 RPMI-1640、DMEM等,并添加10%的胎牛血清(FBS),根据细胞不同,血清浓度可能会有变化,具体以培养细胞时需要的血清浓度为准。
冻存液:(1)一般使用含有 90% 血清 和 10% 二甲基亚砜(DMSO)的冻存液。DMSO 需提前预冷至 4℃以下,且要确保其质量和纯度,避免对细胞造成损伤。将冻存液在冰上或 4℃冰箱中配制,轻轻混匀。
(2)使用即用型细胞冻存液,冻存液使用前保存在4℃冰箱。
冻存管:选用无菌、无 DNase 和 RNase、耐低温的冻存管。在冻存管上清晰标记细胞名称、冻存日期、细胞代数等重要信息,以便后续识别和使用。
水平离心机:确保离心机的转速和离心力准确可靠,能够达到 1000 - 1500 rpm 的转速,用于细胞沉淀收集。提前清洁和消毒离心机转头及离心管套筒,防止交叉污染。
其他耗材:准备无菌的移液枪及配套枪头,不同量程的移液枪应经过校准且在有效期内。枪头需为无菌、无热原的一次性耗材,避免对细胞产生污染。同时,准备适量的 PBS 缓冲液用于细胞洗涤,PBS 缓冲液需提前预热至 37℃。
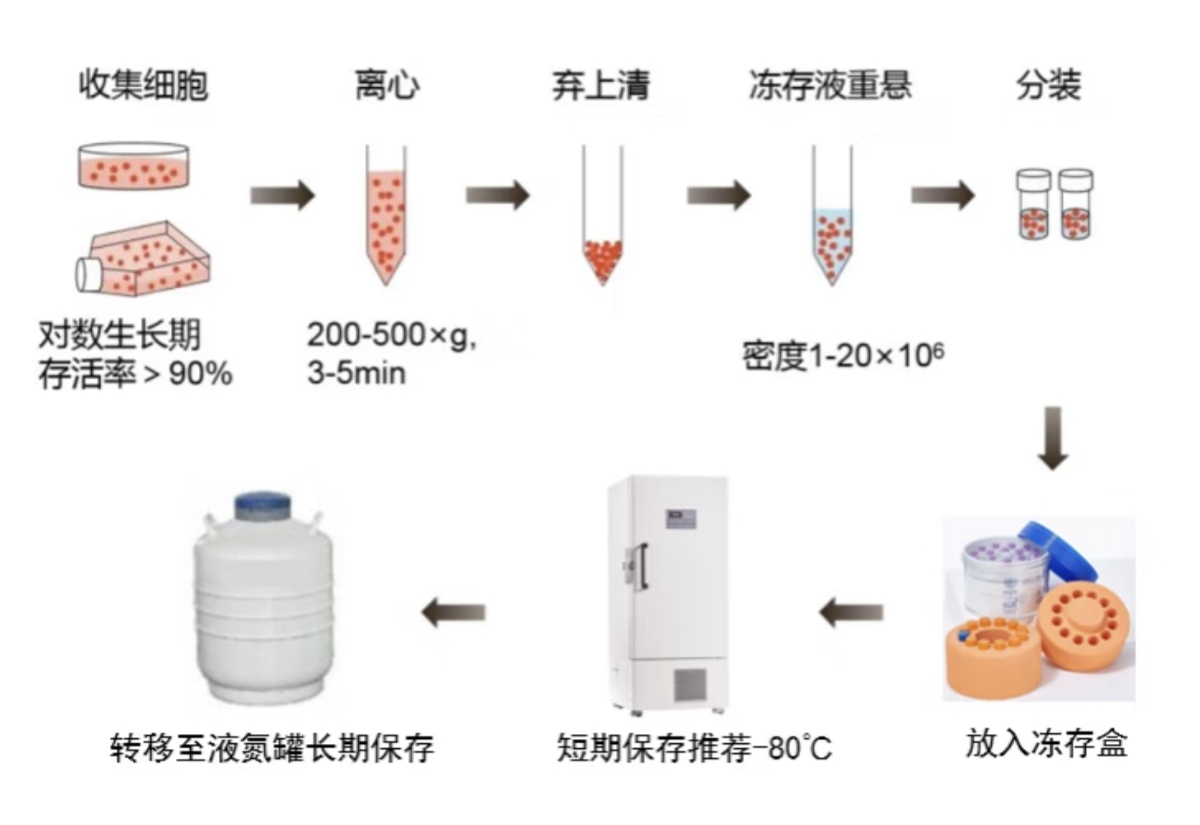
1. 细胞收集:
以T25瓶为例,在超净工作台中,先将培养瓶中的旧培养基轻轻吸出,用预热至 37℃的 PBS 缓冲液缓慢冲洗细胞 2 - 3 次,每次冲洗时 PBS 缓冲液的用量以能覆盖细胞单层为宜,一般为 5 - 10 ml。冲洗的目的是去除残留的培养基和血清,减少其对后续冻存过程的影响。
然后加入适量的胰酶-EDTA 溶液(根据细胞类型和培养瓶大小确定用量,一般 T25培养瓶加入1 ml)
将培养瓶置于 37℃培养箱中消化 1 - 5 分钟。在消化过程中,需密切观察细胞形态变化。当细胞开始变圆、收缩并逐渐从培养容器底部脱离时,用手轻轻拍打培养容器的侧壁,帮助细胞完全脱落。不同细胞类型的消化时间会有所不同,例如,一些上皮细胞可能需要3-5分钟左右,而一些成纤维细胞可能需要2-4分钟左右。
用移液枪轻轻吹打细胞悬液,使细胞充分脱离培养瓶底部并分散均匀,避免产生过多气泡。将细胞悬液转移至15 ml离心管中。
2. 细胞计数与离心:
取少量细胞悬液,使用血细胞计数板或细胞计数仪进行细胞计数,计算细胞浓度和活率。
根据细胞浓度、活率和所需冻存的细胞数量,调整细胞悬液体积;一般冻细胞的密度为1×10^6 - 5×10^6个/ml。
将离心管放入离心机中,设置转速为1000 rpm,离心5分钟。
离心结束后,小心取出离心管,将其置于超净工作台中,缓慢吸出上清液,尽量避免吸到细胞沉淀。
3. 冻存液重悬细胞:
根据细胞沉淀的量,加入适量预冷的冻存液,一般按照1×10^6 - 5×10^6个/ml细胞密度进行重悬。
用移液枪轻轻吹打细胞沉淀,使细胞均匀分散在冻存液中,确保细胞密度适中,避免细胞团聚。
重悬后的细胞,尽量减少细胞存放于室温的时间,尽快进入冻存阶段。
4. 细胞分装与冻存:
将重悬后的细胞悬液分装至标记好的冻存管中,每管分装的细胞悬液体积一般为 1 - 1.5 ml。在分装过程中,要注意避免产生气泡,同时确保冻存管密封良好。
由于使用的冻存方式不同会有不同的冻存方法,请选择合适的冻存步骤。
a. 使用传统方法:将冻存管先放入 4℃冰箱中静置60 分钟,使细胞逐渐适应低温环境。然后将冻存管转移至 -20℃冰箱中放置2小时,接着再放入-80℃冰箱过夜。最后,将冻存管迅速转移至液氮罐中进行长期保存。在转移过程中,要尽量缩短冻存管在室温及 -20℃以上环境中的停留时间,防止细胞受损。
b. 使用冻存盒:将冻存管放入4℃预冷的冻存盒(确保冻存盒已加满或更新异丙醇)中,然后快速将冻存管转移至-80℃冰箱过夜。最后,将冻存管迅速转移至液氮罐中进行长期保存。在转移过程中,要尽量缩短冻存管在室温及 -20℃以上环境中的停留时间,防止细胞受损。
c. 使用细胞冻存液:将冻存管转移至-80℃冰箱过夜,然后将冻存管迅速转移至液氮罐中进行长期保存。在转移过程中,要尽量缩短冻存管在室温及 -20℃以上环境中的停留时间,防止细胞受损。
细胞冻存管:含有待复苏的细胞,需明确标记细胞名称、冻存日期、细胞代数等信息。
细胞培养用培养基:准备适量的细胞培养所用的完全培养基,根据细胞类型确定其配方,如 RPMI-1640、DMEM 等,并添加10%的胎牛血清(FBS),根据细胞不同,血清浓度可能会有变化,具体以培养细胞时需要的血清浓度为准,已在37℃预热。
培养瓶或培养皿:根据细胞的生长特性和后续实验需求选择合适的规格,提前准备好并放置在超净工作台中,添加适量预热的培养基。
水平离心机:确保离心机的转速和离心力准确可靠,能够达到 1000 - 1500 rpm 的转速,用于细胞沉淀收集。提前清洁和消毒离心机转头及离心管套筒,防止交叉污染。
恒温水浴锅:设置温度为 37℃,并保证水温均匀稳定,用于快速解冻细胞。
移液枪及相应枪头:不同量程的移液枪,需经过灭菌处理,枪头应为无菌、无热原。
PBS 缓冲液:已在 37℃预热,用于洗涤细胞。
细胞超净台需要使用 75% 酒精擦拭超净工作台内部,并紫外消毒至少30分钟,以营造一个无菌的操作环境。
在开始细胞复苏前,确保超净工作台已开启并正常运行至少5分钟以上。
检查恒温水浴锅的温度是已稳定在37℃,确保水干净、无菌、无杂质。
确认离心机已提前开启并调整到合适的时间参数,例如对于大多数细胞,常用的离心速度为 1000 – 1500 rpm,离心时间为5分钟。
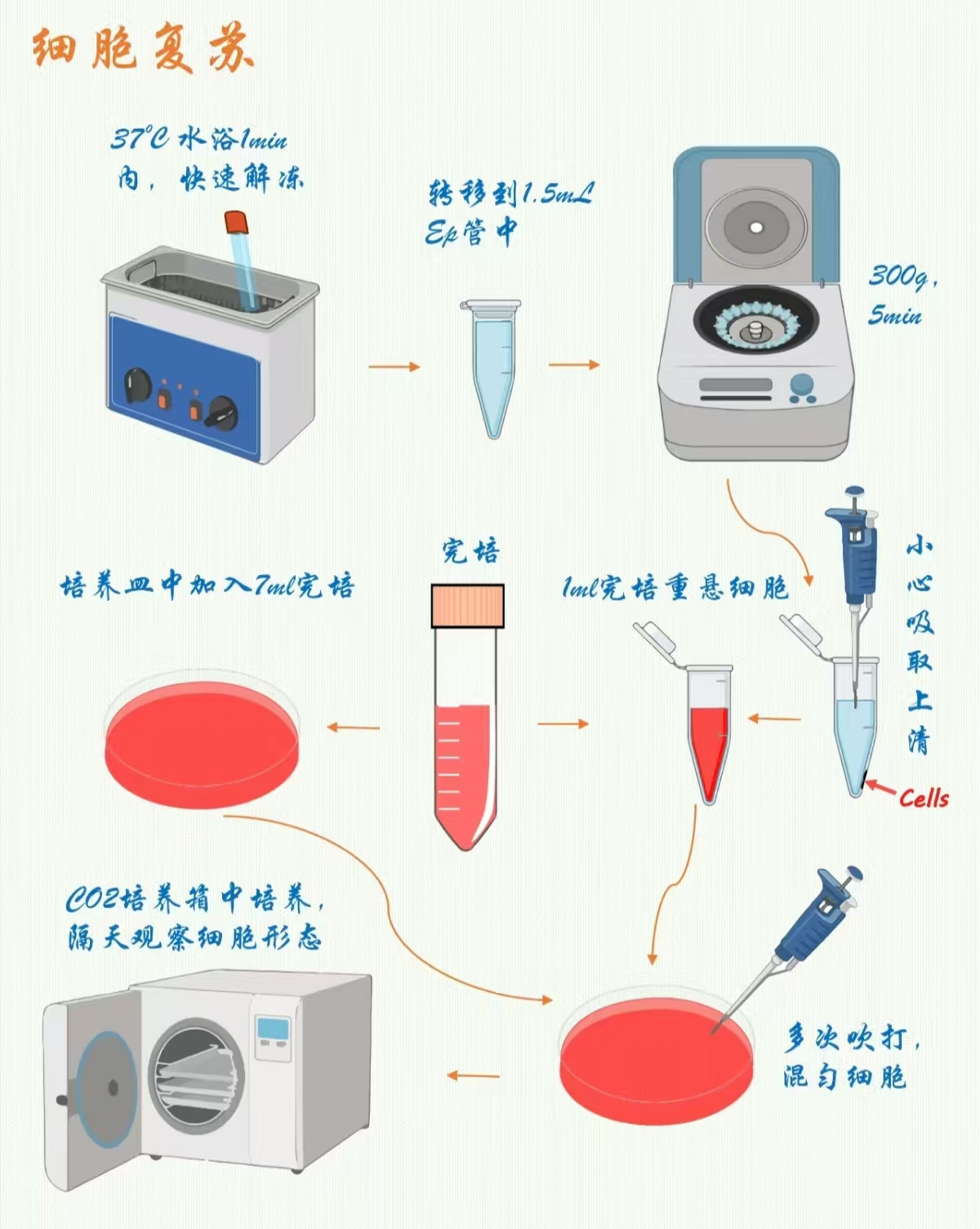
从液氮罐中迅速取出所需的细胞冻存管,为避免液氮冻伤,操作时请戴上厚手套和护目镜。注意要尽量缩短冻存管在液氮外暴露的时间,以防止细胞因温度上升而受损。
立即将冻存管放入已预热至 37℃的恒温水浴锅中,轻轻晃动冻存管,使管内细胞悬液快速解冻。注意观察,当管内仅剩下少量冰晶或小冰球时,即可取出冻存管,整个过程通常需要约1-2分钟。
用 75% 酒精喷洒并擦拭冻存管表面,将其转移至超净工作台内。
打开冻存管,使用移液枪将解冻后的细胞悬液缓慢加入到含有预热培养基的离心管中,一般冻存的细胞体积与完全培养基的比例为1:5-9,也就是1 ml的冻存细胞,要加入到5-9 ml预热的培养基中,以稀释 DMSO 对细胞的毒性影响。轻轻混匀,动作要轻柔,避免产生过多气泡。
将含有细胞的离心管放入离心机中,1000 rpm,离心5分钟,使细胞沉淀。
离心结束后,小心取出离心管,避免震动使细胞重新悬浮。使用移液枪缓慢吸出上清液,注意不要扰动细胞沉淀。
以接种T25瓶为例,向离心管中加入2 ml适量预热的新鲜培养基。使用移液枪轻轻吹打细胞沉淀,使细胞均匀分散,避免过度吹打造成细胞损伤。
取少量重悬液,一般为20-50 μl,使用血细胞计数板或细胞计数仪进行细胞计数,计算细胞浓度和活率。如果细胞活率过低,提示冻存或复苏的细胞可能存在大量死亡,有可能导致细胞复苏失败。
将重悬后的细胞悬液转移至预先准备好的培养瓶或培养皿中,按照不同的培养瓶或培养皿补足完全培养基,轻轻摇晃培养瓶或培养皿,使细胞均匀分布在底部,然后将其放入 37℃、5% CO₂培养箱中培养。如T25瓶中,Hela细胞一般接种密度为0.5×10^6 - 1×10^6个细胞,不同的细胞接种密度可能会不同,可根据不同的细胞或培养容器调整细胞的接种密度。
复苏后的细胞在培养箱中培养一段时间后,可使用倒置显微镜观察细胞的贴壁和生长情况。一般在 12-24小时后开始观察,检查细胞是否贴壁,形态是否正常。
根据细胞的生长情况,适时更换培养基,以去除可能残留的 DMSO 和死亡细胞碎片等有害物质,促进细胞的健康生长。
细胞:选择处于对数生长期(一般密度为80%-95%,不要使细胞长得过密)、状态良好且无污染的细胞进行冻存。在冻存前一天,更换新鲜的完全培养基,确保细胞处于最佳生长状态。
培养基:准备适量的细胞培养所用的完全培养基,根据细胞类型确定其配方,如 RPMI-1640、DMEM 等,并添加10%的胎牛血清(FBS),根据细胞不同,血清浓度可能会有变化,具体以培养细胞时需要的血清浓度为准。
PBS 缓冲液(不含钙和镁):用于洗涤细胞,去除残留的培养基和代谢产物,在 37℃预热。
胰酶-EDTA溶液:用于从培养容器底部消化细胞,使其脱离并分散成单个细胞悬液,也需要在 37℃中预热。
水平离心机:确保离心机的转速和离心力准确可靠,能够达到 1000 - 1500 rpm 的转速,用于细胞沉淀收集。提前清洁和消毒离心机转头及离心管套筒,防止交叉污染。
其他耗材:准备无菌的移液枪及配套枪头,不同量程的移液枪应经过校准且在有效期内。枪头需为无菌、无热原的一次性耗材,避免对细胞产生污染。同时,准备适量的 PBS 缓冲液用于细胞洗涤,PBS 缓冲液需提前预热至 37℃。
培养瓶或培养皿:根据细胞的生长特性和实验需求,准备好相应规格的培养瓶或培养皿,需为无菌、无热原的一次性耗材,避免对细胞产生污染。
细胞超净台需要使用 75% 酒精擦拭超净工作台内部,并紫外消毒至少30分钟,以营造一个无菌的操作环境。
在开始细胞传代前,确保超净工作台已开启并正常运行至少5分钟以上。
确认离心机已提前开启并调整到合适的时间参数,例如对于大多数细胞,常用的离心速度为 1000 – 1500 rpm,离心时间为5分钟。
检查细胞的生长状态,在显微镜下观察细胞密度和形态,确保细胞处于对数生长期,一般细胞汇合度达到80%-95%时是传代的最佳时机。对于不同的细胞类型,汇合度的要求可能会有所不同,可根据细胞的生长特性进行调整。
在超净工作台中,小心地从培养容器中吸出旧的培养基,注意避免吸到细胞。
沿培养容器壁缓慢加入适量预热的 PBS 缓冲液,以覆盖细胞为宜,轻轻晃动培养容器,使 PBS 缓冲液均匀覆盖细胞,然后倒掉,重复此步骤 1 - 2 次,以彻底清除残留的培养基和细胞代谢产物。
加入适量的胰酶-EDTA 溶液(根据细胞类型和培养瓶大小确定用量,一般 T25培养瓶加入1 ml)
将培养瓶置于37℃培养箱中消化1-5分钟。在消化过程中,需密切观察细胞形态变化,当细胞开始变圆、收缩并逐渐从培养容器底部脱离时,用手轻轻拍打培养容器的侧壁,帮助细胞完全脱落。不同细胞类型的消化时间会有所不同,例如,一些上皮细胞可能需要3-5分钟左右,而一些成纤维细胞可能需要2-4分钟左右。
立即加入等体积的完全培养基终止消化,用移液枪轻轻吹打培养容器内的液体,使细胞均匀分散成单个细胞悬液。注意吹打力度要适中,避免产生过多气泡,因为过多气泡可能会对细胞造成损伤。
将细胞悬液转移至15 ml离心管中。
将离心管放入离心机中,设置转速为1000 rpm,离心5分钟。
离心完成后,小心取出离心管,将其轻轻放置在超净工作台内,用移液枪小心吸出上清液,尽量避免打散细胞沉淀。
向离心管中加入3 ml预热的细胞培养基,使用移液枪轻轻吹打细胞沉淀,使细胞重新悬浮。
取少量细胞悬液,使用血细胞计数板或细胞计数仪进行细胞计数,计算细胞浓度和活率。
根据传代的目标培养容器和细胞接种浓度,确定所需的细胞悬液体积。例如,如果要将细胞以 1:3 的比例传代,且原细胞悬液的细胞浓度为1×10^6个/ml,则需要将细胞悬液稀释至合适的体积,使得最终每瓶细胞的接种浓度在合适范围,通常为1-2×10^5个/ml。例如,如果要将细胞接种到三个 T25 培养瓶中,每个培养瓶中接种 5 ml 细胞悬液。
轻轻晃动培养容器,使细胞均匀分布在容器底部,然后将其放入 37℃、5% CO₂培养箱中继续培养。
整个操作过程必须在严格的无菌条件下进行,操作人员需穿戴无菌实验服、手套和口罩,超净工作台在使用前需用紫外线照射消毒 30 分钟以上,并定期进行清洁和维护。操作时,双手和使用的器械要经常用 75% 酒精擦拭消毒。
不同细胞类型对胰酶-EDTA 溶液的敏感性不同,消化时间需要根据实际情况调整,防止消化过度或不足。消化过度会损伤细胞,消化不足则会导致细胞难以分散成单个细胞悬液。
细胞计数要准确,以确保传代后细胞的接种密度合适,避免细胞生长过密或过稀,影响细胞的生长和实验结果。
传代后,要密切观察细胞的生长情况,根据细胞的生长速度和状态,适时更换培养基,一般在细胞贴壁后的 24 - 48 小时进行第一次换液。
在使用离心机时,要确保离心管的平衡,防止因不平衡导致离心管破裂或细胞损伤。
DMSO 对细胞具有一定的毒性,因此在使用过程中要严格控制其浓度和与细胞接触的时间。同时,由于DMSO在低温下易结晶,所以要确保其充分预冷后再与细胞悬液混合。
细胞冻存的速度至关重要,过快或过慢都可能影响细胞的存活率。采用梯度降温的方法可以减少细胞内冰晶的形成,从而保护细胞。在将冻存管放入液氮罐时,要确保液氮罐的安全性和稳定性,定期检查液氮量,及时补充液氮,以维持细胞所处的低温环境。
细胞冻存记录要详细准确,包括细胞名称、冻存日期、细胞代数、冻存管编号等信息,以便后续查找和使用。同时,建议建立细胞冻存档案,对每次冻存的细胞情况进行详细记录和跟踪。
解冻过程要迅速,防止冰晶在细胞内形成和细胞受损。同时,避免过度晃动冻存管,防止细胞机械损伤。
细胞复苏后的最初几天,可能会出现一定比例的细胞死亡,这是正常现象。如果细胞死亡比例过高,可能是冻存或复苏过程出现问题,需要仔细检查各个操作步骤。
不同类型的细胞对复苏条件的敏感性可能有所不同,在进行新的细胞复苏操作前,建议查阅相关细胞的文献或咨询有经验的科研人员,以获取更适合的复苏条件和细节。
在复苏细胞时,要严格按照细胞复苏的操作规程进行,快速将冻存管从液氮中取出,置于 37℃水浴中迅速解冻,避免细胞在解冻过程中受到损伤。解冻后,要尽快将细胞转移至合适的培养环境中进行培养,并密切观察细胞的生长状态。